スルホン酸のケクレ式2017/05/10(水)
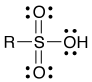
先日の有機化学の復習問題で、スルホン酸誘導体の構造式が出てきました。普通はこう書きますよね。
ところが、受講生の中で「S は価電子6個でしょ? 結合が6本って…全部の価電子で共有結合を作る?」と疑問に思った人がいました。至極もっともな疑問なのですが、気がついた人は偉い。どの本を見ても、たいがい上のように書いてあるわけですよ。書いてあることを鵜呑みにしなかったのか、別の記法で書いてある本を見つけたのか、それとも横着して何も参照しなかったのか(笑)、まあいずれにしても、こういうことを自分で考えるのは価値あることです。
それで、どう考えればよいのでしょうか。まず、実験的事実として、スルホン酸の S 原子は四面体構造です。(下の図は量子化学計算による予測構造ですが、実測の構造も大きくは変わりません。)
四面体構造なのですから、S は sp3 混成軌道を使って結合を作っている、と予想されますね。そうすると、O と二重結合を作るための軌道が残らないのです。かつては、S の 3d 軌道を使って二重結合ができる、と考えられていましたが、量子化学計算をやってみると、3d 軌道と O のローンペアはほとんど相互作用がないことがわかります。おそらく、軌道のエネルギーが大きく異なるためと思われます。
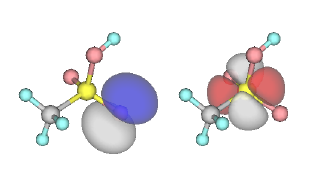
左は O のローンペア、右は S の 3d 軌道の1つ。
一見結合を作れそうだが、実際にはほとんど相互作用していない。
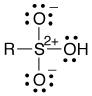
すなわち、S–O は単結合です。O の手が一本だと O の上に不対電子が残ることになるので、S から一個電子をもらうことでローンペアを3つ作っています。つまり、ケクレ式で書くと下のようになります。
「形式電荷2+」というのが異様ですが、これが正しい表記になります。ただ、やはり違和感のある表記法なので、S と O の間に二重結合を書くケクレ式も、まだ当面は使われるでしょうね。私の担当する講義では、「どちらでもよい」ことにしようと思います。